Differenza tra saponificazione e neutralizzazione
 Share
Share
Differenza principale - Saponificazione vs neutralizzazione
La saponificazione e la neutralizzazione sono reazioni chimiche molto importanti che vengono utilizzate su scala di laboratorio e su scala industriale. La saponificazione è generalmente la formazione di sapone sotto forma di sospensione. Ciò si verifica a causa della scissione di un trigliceride in glicerolo e acidi grassi. La neutralizzazione è la formazione di un mezzo neutro dopo che una reazione chimica ha avuto luogo. Questo può essere osservato principalmente nelle reazioni acido-base. Gli acidi sono in grado di rilasciare H+ Gli ioni e le basi sono in grado di rilasciare OH- ioni. Quando tutto H+ Gli ioni rilasciati dall'acido reagiscono con tutto l'OH- Gli ioni rilasciati dalla base, si dice che il mezzo è stato neutralizzato. La principale differenza tra saponificazione e neutralizzazione è quella la saponificazione comprende la scissione di un estere in alcool e lo ione carbossilato mentre la neutralizzazione include la formazione di un mezzo neutro dopo la reazione chimica.
Aree chiave coperte
1. Cos'è la saponificazione
- Definizione, meccanismo, salatura
2. Cos'è la neutralizzazione
- Definizione, diversi tipi
3. Qual è la differenza tra saponificazione e neutralizzazione
- Confronto tra le principali differenze
Termini chiave: basicità, acido carbossilico, estere, esotermico, acidi grassi, glicerolo, idrossido di potassio, saponificazione, sapone, trigliceridi

Cos'è la saponificazione
La saponificazione è un processo mediante il quale i trigliceridi reagiscono con l'idrossido di sodio o di potassio per produrre glicerolo e un acido grasso chiamato "sapone". La saponificazione comprende la scissione di un estere in acido carbossilico e alcol utilizzando NaOH o KOH in presenza di acqua. Qui, a causa della basicità del mezzo, lo ione carbossilato viene prodotto al posto dell'acido carbossilico.
Un trigliceride è un estere derivato dalla reazione tra un glicerolo e acidi grassi. Qui, una molecola di glicerolo è combinata con tre molecole di acido grasso. Ogni acido grasso ha un gruppo acido carbossilico. La molecola di glicerolo ha tre gruppi idrossile (-OH). Quindi, tre acidi grassi possono combinarsi con questi tre gruppi idrossilici che formano l'estere. Nella saponificazione, tre acidi grassi si separano dal glicerolo.
Il meccanismo di saponificazione include i seguenti passaggi:
- Attacco nucleofilo
- Lasciando la rimozione del gruppo
- deprotonazione

Figura 1: Meccanismo di saponificazione
In generale, la reazione chimica tra qualsiasi grasso e NaOH è la saponificazione. La reazione è esotermica, in cui il calore è liberato all'ambiente circostante. Quando il sapone si forma tramite saponificazione, rimane come una sospensione. Quindi il sapone può essere separato attraverso il sapone per la salatura (formazione di sapone solido dalla sospensione aggiungendo sale comune alla sospensione).
Cos'è la neutralizzazione
Una reazione di neutralizzazione è una reazione chimica tra un acido e una base che produce una soluzione neutra. Una soluzione neutra avrà sempre il pH 7. Questa reazione implica la combinazione di H+ ioni e OH- ioni per formare molecole d'acqua.
Se il pH finale di una miscela di reazione di acido e base è 7, ciò significa pari quantità di H+ e OH- Gli ioni hanno reagito qui (per formare una molecola d'acqua, una H+ ione e uno OH- sono richiesti ioni). Gli acidi e le basi reagiti possono essere forti o deboli. Le reazioni variano a seconda di questo fatto.
Forte neutralizzazione della base acido-forte
- Gli acidi forti e le basi forti sono completamente dissociati in ioni in mezzo acquoso. Quindi rilasciano tutti i possibili H+ e OH- ioni nel mezzo.
Debole neutralità acido-debole della base
- Questo tipo di reazione non fornisce una completa neutralizzazione perché gli acidi deboli e le basi deboli non si dissociano completamente nei loro ioni. Quindi, un acido debole non può essere neutralizzato da una base debole e viceversa.
Debolezza della neutralità dell'acido debole forte
- La neutralizzazione di un acido debole con una base forte conferisce al terreno un pH superiore a 7.
Forte neutralità acido-debole della base
- La neutralizzazione di un acido forte con una base debole si traduce in un pH basso di 7.
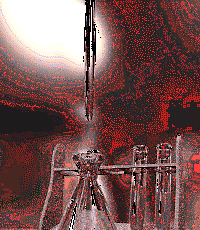
Figura 2: esecuzione di una reazione acido-base
Differenza tra saponificazione e neutralizzazione
Definizione
Saponificazione: La saponificazione è un processo mediante il quale i trigliceridi reagiscono con l'idrossido di sodio o di potassio per produrre glicerolo e un acido grasso chiamato "sapone".
Neutralizzazione: Una reazione di neutralizzazione è una reazione chimica tra un acido e una base che produce una soluzione neutra (pH = 7).
Principio
Saponificazione: La saponificazione include la scissione di un estere in alcool e ione carbossilato.
Neutralizzazione: La neutralizzazione include la formazione di un mezzo neutro dopo la reazione chimica.
Prodotti finali
Saponificazione: La saponificazione dà glicerolo e un sale di acidi grassi (sapone).
Neutralizzazione: La neutralizzazione dà un sale e acqua.
Reazione chimica
Saponificazione: La saponificazione include la reazione tra un estere e l'idrossido di sodio o di potassio in presenza di acqua.
Neutralizzazione: La neutralizzazione include la reazione tra un acido (forte o debole) e una base (forte o debole).
Risultato finale
Saponificazione: Saponificazione forma sapone come una sospensione che può essere separata tramite salatura dal sapone.
Neutralizzazione: Neutralizzazione forma un terreno con pH 7.
Conclusione
La saponificazione è fondamentalmente la formazione di sapone. Ciò comporta la scissione di un estere in alcool e acido carbossilico (in un mezzo di base, lo ione carbossilato è formato). La neutralizzazione, d'altra parte, è la formazione di un mezzo neutro dopo la reazione tra un acido e una base. La principale differenza tra saponificazione e neutralizzazione è che la saponificazione include la scissione di un estere in alcool e ione carbossilato mentre la neutralizzazione include la formazione di un mezzo neutro dopo la reazione chimica.
Riferimento:
1. Helmenstine, Anne Marie. "Definizione e reazione di saponificazione". ThoughtCo, 3 ottobre 2017, disponibile qui.
2. Libretexts. "Saponification". Chemistry LibreTexts, Libretexts, 21 luglio 2016, disponibile qui.
3. Helmenstine, Anne Marie. "Neutralization Definition." ThoughtCo, 26 aprile 2016, disponibile qui.
Cortesia dell'immagine:
1. "Wikipedia ester hydrolysis." Di Chem540grp5f08 - Opera propria (di pubblico dominio) via Commons Wikimedia
2. "Titolazione" di Jfreyre ~ commonswiki ipotizzato - Presa in carico del proprio lavoro (basata su rivendicazioni sul copyright) (CC BY-SA 2.5) via Commons Wikimedia
